เนื้อหาแบบสรุปสั้นๆ : http://www.rmutphysics.com/physics/oldfront/electron-structure/transparency/atom-str-SL.pdf
[Flash] เนื้อหาบางเรื่องต้องใช้จินตนาการ ตอนอ่านอาจจะทำความเข้าใจยากหน่อย ดูเนื้อหาจากฟิสิกส์ราชมงคล(เป็นภาพเคลื่อนไหว)จะเข้าใจง่ายขึ้นค่ะ
1.แบบจำลองอะตอมของนักวิทยาศาสตร์ : Atomic-Structure 1
2.วงโคจรของอิเล็กตรอน : Atomic-Structure 2
3.ปรากฎการณ์โฟโตอิเล็กตริก : Atomic-Structure 3
4.โมเมนตัมของแสง : Atomic-Structure 4
5.เลขควอนตัม : Atomic-Structure 5
6.บรรจุอิเล็กตรอนในออร์บิทัล : Atomic-Structure 6
7.เลขอะตอมมิก : Atomic-Structure 7
8.ใจกลางเครื่องปฏิกรณ์ : Atomic-Structure 8
**ดูหัวข้อที่อาจารย์สอนใน class ประกอบด้วย ถ้าเรื่องไหนไม่มีก็ไม่จำเป็นต้องอ่านละเอียดค่ะ แค่พอรู้ก็พอ
**เนื้อหาที่เอามาลงให้เป็นเนื้อหาที่หลายๆคนมักจะบ่นว่าเข้าใจยาก มีอยู่ 2 เรื่องคือเลขควอนตัมกับเทอร์โมไดนามิคส์ค่ะ ส่วนเรื่องที่เหลือเนื้อหาค่อนข้างเหมือนม.ปลาย แค่ทบทวนนิดหน่อยก็เข้าใจค่ะ
1.) เลขควอนตัมหลัก (n) (Principle quantum number)

**เนื้อหาที่เอามาลงให้เป็นเนื้อหาที่หลายๆคนมักจะบ่นว่าเข้าใจยาก มีอยู่ 2 เรื่องคือเลขควอนตัมกับเทอร์โมไดนามิคส์ค่ะ ส่วนเรื่องที่เหลือเนื้อหาค่อนข้างเหมือนม.ปลาย แค่ทบทวนนิดหน่อยก็เข้าใจค่ะ
สรุป เลขควอนตัม (Quantum number)
เลขควอนตัมคือ ตัวเลขหรือสัญลักษณ์ที่ใช้อธิบายสมบัติของอนุภาคขนาดเล็กมากๆหรืออิเล็กตรอนที่อยู่ในอะตอม เลขควอนตัมมีอยู่ 4 ชนิด คือ n, l, ml , ms1.) เลขควอนตัมหลัก (n) (Principle quantum number)
- บอกถึงระดับพลังงานหลัก
- เลขจำนวนเต็มบวก มีค่า 1,2,3…
# ถ้า n มีค่ามาก แสดงว่าอิเล็กตรอนอยู่ห่างนิวเคลียสมากและมีพลังงานมาก(ไม่เสถียร)
2.) เลขควอนตัมออร์บิทัล (l) หรือ เลขควอนตัมโมเมนตัมเชิงมุม (Angular momentum quantum number)
- บอกรูปร่างของออร์บิทัลที่ e- อยู่ ซึ่งค่า l เป็นเลขจำนวนเต็ม ขึ้นกับค่า n
- l มีค่าตั้งแต่ 0,1,2… , n-1 (มีทั้งหมด n ค่า)
เช่น e- มี
n = 3 จะมีค่า l = 0,1,2
·l = 0 เรียก s orbital
·l = 1 ,, p orbital
·l = 2 ,, d orbital
·l = 3 ,, f orbital
·l = 4 ,, g orbital
3.) เลขควอนตัมแม่เหล็ก (ml) Magnetic quantum number
- บอกจำนวน ออร์บิทัล ในระดับพลังงานหลัก
- แสดงทิศทางการจัดตัวของ ออร์บิทัล
- ค่า ml เป็นเลขจำนวนต็ม ขึ้นกับค่า l
- ml มีค่าระหว่าง l ถึง – l
- รวม 2l + 1 ค่า
•l =
0 , ml = 0 (s)
•l =
1 , ml = 0, +1,
-1 (px, py, pz)
•l =
2 , ml = 0, +1,
+2, -1, -2 (dxy, dyz, dxz, dx2-y2, dz2)
•l =
3 , ml = 0, +1,
+2,+3, -1, -2,-3 (f ไม่ต้องไปสนใจค่ะ มันยุ่งยาก) | ||||
| (s-orbitals) |
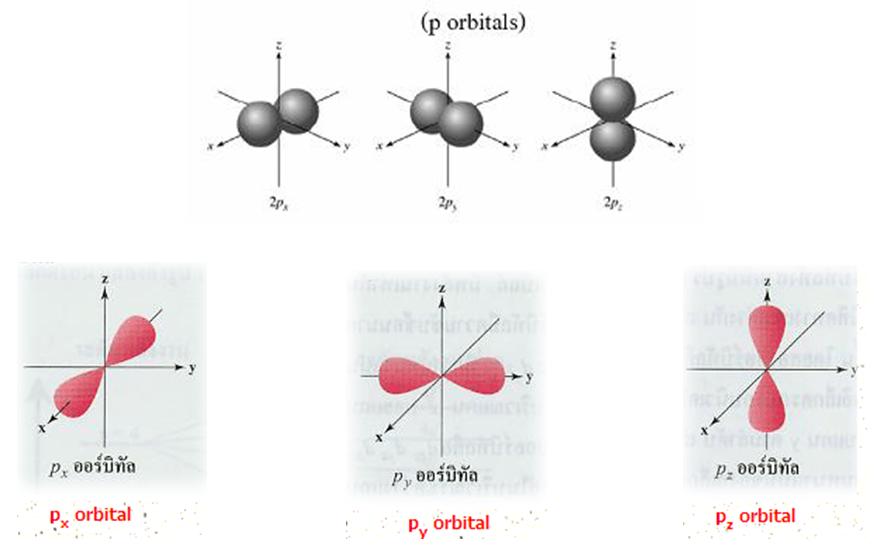 |
| (p-orbitals : px, py, pz จะเห็นว่าถ้า n(ระดับพลังงานหลัก:เลขที่อยู่หน้าp)เพิ่มขึ้น ขนาดออร์บิทัลจะใหญ่ขึ้น) |
| (d-orbitals : dxy, dyz, dxz, dx2-y2, dz2) |
4.) เลขควอนตัมสปิน, ms(Spin quantum number)
-เป็นตัวเลขบอกทิศทางการหมุนรอบตัวเองของ e- มีค่า + ½ , - ½
•ms = +½ à e- อยู่ในสภาพ สปินขึ้น
No comments:
Post a Comment